抓住實驗異常 挖掘背后成因
劉瑛

【摘? 要】實驗異常現象的出現,會使師生產生不同程度的認知沖突或出現情緒緊張的狀態。對異常現象的應對和處理,是體現教學機智和專業素養的重要時刻。本文分析了高中化學必修第二教學中出現的幾個實驗異常現象,并作出了科學合理的解釋,最后就合理規避或利用異常現象提出了思考與建議。
【關鍵詞】化學實驗;異常現象;認知沖突
一、問題的提出
化學是一門建立在實驗基礎上的學科,實驗在化學教學中有著不可替代的作用。凡事預則立,不預則廢,化學實驗亦然。明確實驗目的、分析實驗原理和預測實驗現象是進行化學實驗前所必須完成的步驟。實驗教學中的種種情況都在預設范圍內,教師在課堂上就會游刃有余,得心應手。
在上現場課和公開課時,異常現象的出現會加重緊張情緒,大多數教師都愿退避三舍,敬而遠之。在進行演示實驗或分組實驗時,執教者多期望看到預期的實驗現象,對異常現象存有畏懼之心。實驗異常的出現,會讓教師或學生的原有觀念與新經驗之間產生對立性矛盾,并對異常現象產生疑惑、出現情緒緊張或不適的狀態,即產生認知沖突。如何應對此種狀況,是值得我們思考的地方。
二、關注異常現象,挖掘背后成因
實驗教學中出現的異常現象,多與試劑來源、裝置設計、反應原理和實驗操作等有關,但是理論分析是一枝獨秀,實際情況卻是百花齊放。專業知識的大量儲備和實踐經驗的長期積累,是應對復雜多變的課堂教學的有效保障。筆者在進行高中化學必修二的教學時,實驗中出現了幾個異常現象,現分析如下。
(一)“探究影響化學反應速率的因素”實驗教學中的異常及應對
1.教學片段
學生在實驗中發現了異常現象,標注為0.1mol/L鹽酸與Zn片反應的速率竟然比1mol/L鹽酸與同樣大小同樣形狀的Zn片反應速率快。這一異常現象讓筆者也緊張了起來,用“實驗員可能將標簽貼反了,可能是藥品配制過程中出了差錯,也可能是其他什么原因,老師下課了解一下”搪塞過去了,但是學生在下課聊天的時候樂此不疲地與同伴分享著這一趣事。筆者意識到這一“烏龍事件”可能會產生無法估量的蝴蝶效應,必須揭示背后成因,在課堂上與同學共同分析討論。
2.揭示原因
實驗小組所用的0.1mol/L鹽酸是從藥品柜中拿出來的,且從初次配制至此次使用已相隔幾年時間。因滴瓶的橡膠塞全部老化開裂,故在使用前全部替換成新橡膠塞。筆者用5-8小組使用的鹽酸和藥品柜中保存的0.1mol/L的鹽酸分別再次進行了實驗,與學生所得實驗現象相同;而用準備室中臺面上放置的相應濃度的鹽酸做實驗,現象卻是與預期相同的。因此,實驗員貼錯標簽的可能性為零,造成實現現象異常的原因與鹽酸在保存過程中發生的變化有關。濃鹽酸具有揮發性,會使其濃度變小,按照思維定勢,實驗室保存的0.1mol/L的鹽酸亦會變稀,實驗對比結果應該不會逆轉,但是實驗事實確是如此,通過查閱大學《物理化學》課本找到了原因。
對于同一系統,其所含物質數量的多少隨人們研究問題的出發點不同而不同,但是平衡系統的組分數卻始終保持一定值,所以,組分數是表征系統性質的一個重要參數。組分數不僅與物質種數有關,還與化學反應條件、濃度限制條件等有關。組分數等于系統中的物種數減去獨立的化學平衡數,再減去同一相的獨立濃度限制條件數。對于HCl和H2O組成的溶液而言,若不考慮它們的電離,其平衡系統中所含的組分數是2。若要考慮,則根據反應:2H2O? ? H3O++OH-,HCl=H++Cl-,可知組分數=6-2-2=2,仍然不變。
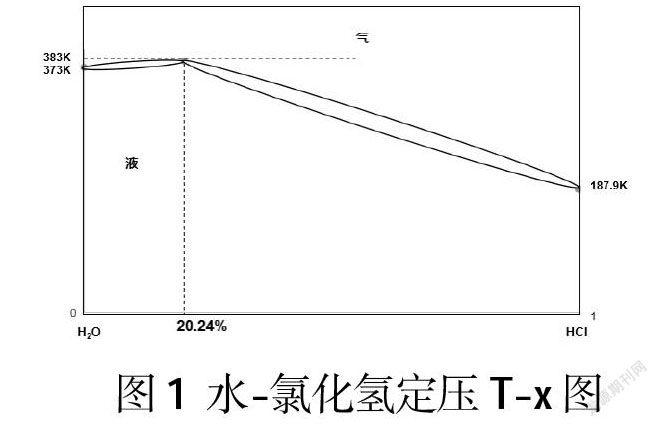
對于二組分系統而言,影響其狀態的因素有溫度、壓力和組成。試劑是在常壓下保存的,所以可以固定壓力,繪制沸點(T)-組成(x)圖(見圖1)。由于HCl溶于水后完全電離,使得揮發性發生改變,在T-x圖上出現最高點,即最高恒沸點383K,該點上氣、液兩相組成相同,HCl的質量分數為20.24%。373K、187.9K分別為水和氯化氫的沸點。根據柯諾華諾夫第一規則,較易揮發組分在氣相中的成分大于在液相中的成分,即溶液中沸點低的組分在氣相中的成分總比在液相中的大,所以T-x圖的氣相線總是在液相線上方。
據圖可知,當組分處于左半部時,則分餾結果得到純水和HCl-H2O恒沸混合物。當組分利于右半部分時,則分餾結果得到HCl和和HCl-H2O恒沸混合物。藥品柜中保存的鹽酸初始濃度是0.1mol/L,恒沸混合物的濃度約為6mol/L,故保存于藥品柜中的稀鹽酸在存放過程中,因滴瓶膠塞老化、密封性較差等原因,氣相物質會不斷揮發,且揮發出來的是較多的H2O和較少的HCl,液相組成逐漸向中間恒沸混合物移動,濃度逐漸增大。由此可知,稀鹽酸(質量分數小于20%)在長期存放過程中,因較多的H2O和較少的HCl揮發,導致濃度升高,故出現異常實驗現象。
(二)“乙醇的性質”實驗教學中的異常及應對
1.教學片段
“乙醇的性質”教學中,通過復習鞏固乙烯的性質,引出乙醇的工業制法——乙烯直接水化法,即在加熱、加壓和有催化劑存在的條件下,乙烯與水發生加成反應得到乙醇,繼而進行乙醇的性質探究部分。為了驗證乙醇與Na的反應,教師提出思考問題:實驗所需試劑有何要求?乙烯水化法所得乙醇能否直接進行實驗?如若不行,如何使其滿足實驗要求。因水可以與Na反應,學生多認為需要用純乙醇來進行實驗。乙烯水化法所得乙醇中混有水,可利用蒸餾的方法得到純乙醇。教師給出事實證據——蒸餾法得到的乙醇濃度最高為95.6%。這一事實與學生的原有認知產生沖突,據此介紹無水乙醇的制備方法之一——將新煅燒的CaO置于95%的乙醇中,先冷凝回流一段時間后,再蒸餾,可得無水乙醇。
教學中對無水乙醇的制備進行了重點強調,但是在后期作業評價中發現,學生的掌握得并不是很好,多停留在原有認知的水平上。故需要在形成認知沖突處再下一劑猛藥,讓學生知其然,亦知所以然。
2.揭示原因
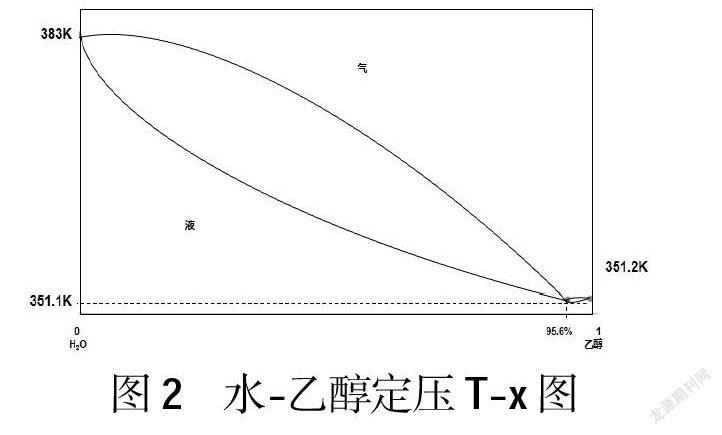
乙醇與水組成的溶液是二組分系統,繪制沸點(T)-組成(x)圖(見圖2)。由于乙醇溶于水后與水分子間形成氫鍵,使得揮發性發生改變,在T-x圖上出現最低點,即最低恒沸點351.1K。該點上氣、液兩相組成相同,乙醇的質量分數為95.6%,改變溫度時,氣相和液相的組成均保持恒定。373K、351.2K分別為水和乙醇的沸點,氣相線在液相線上方。
乙烯水化法所制得的乙醇,其組分處于圖像左半部,故在蒸餾過程中,揮發出來的是較多的乙醇和較少的水,氣相取出后再部分冷凝,經過多次反復降溫、冷凝,氣相組成將逐漸往右下端移,直至恒沸混合物。在進一步的蒸餾過程中,組成保持不變,得到的始終是乙醇-水恒沸混合物,得不到純乙醇。所以為了得到純乙醇,需要在高濃度乙醇的基礎上,利用CaO與水的反應將微量的水除去。
(三)“乙烯的性質”實驗教學中的異常及應對
1.教學片段
濃硫酸分子內脫水是實驗室制備乙烯的常用方法,但是筆者親自進行實驗后發現效率低且副反應明顯,故放棄了利用此法制備乙烯。有一線教師利用乙烯利來快速制備乙烯,筆者自己在花卉市場也買了一瓶乙烯利,以便進行乙烯與溴的四氯化碳反應的演示實驗。
實驗猜想:根據乙烯的結構特點,類比甲烷的性質,乙烯和溴的四氯化碳能反應嗎?若反應,可以觀察到什么現象?若反應,屬于什么反應類型,是取代反應嗎?如何用實驗進行驗證?實驗驗證:教師進行演示實驗,將乙烯利與NaOH混合,現場制乙烯,并將其通入到溴的四氯化碳溶液中,溶液褪色;再向溶液中滴加幾滴HNO3酸化的AgNO3溶液,產生白色沉淀。
產生白色沉淀這一實驗現象屬異常現象,與學生通過預習所得認知相沖突,與教師預期現象亦有不同,屬于課堂生成問題。
2.揭示原因
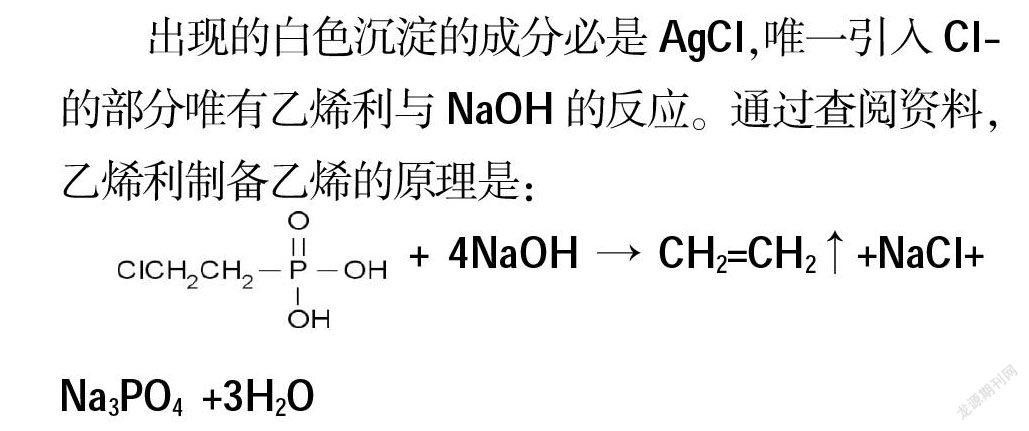
出現的白色沉淀的成分必是AgCl,唯一引入Cl-的部分唯有乙烯利與NaOH的反應。通過查閱資料,乙烯利制備乙烯的原理是:
+ 4NaOH → CH2=CH2↑+NaCl+
Na3PO4 +3H2O
該反應中,NaOH溶于水大量放熱,且演示實驗中所用分液漏斗管口處離底部較近,導致乙烯氣體快速生成時,溶液中的NaCl隨氣流一起進入后續裝置,即HNO3酸化的AgNO3溶液中。故要排除NaCl等因素的影響,可將氣流進行降溫處理,使得NaCl進入液相,不隨氣相一起進入后續裝置。為了避免干擾,筆者進行了實驗改進,提前將乙烯制備好并收集在儲氣袋中,再進行實驗,未觀察到沉淀生成。另外,考慮到HBr難溶于CCl4,易揮發,且溴可與水反應生成HBr干擾實驗結果,所以向通入乙烯之后的溴的CCl4溶液中加入HNO3酸化的AgNO3溶液來檢驗HBr的存在有不合理之處。在第二個教學班進行教學時,做出了改進,即將乙烯與溴的CCl4溶液反應后的氣體先通入CCl4中除去可能揮發出來的溴蒸氣,再通入HNO3酸化的AgNO3溶液中。在出現異常現象的教學班中,對產生異常的原因做了詳盡的分析,并引導學生改進了設計方案,以實現培養學生科學探究的能力,并強化學生的證據推理意識。
3.點擊高考
對“乙烯的性質”實驗教學中異常現象的分析,并非閉門造車、自圓其說,實則有理可依、有跡可循。在2020年浙江卷中,濃硫酸與濃鹽酸混合制備HCl時,生成的氣體通入硝酸鋇溶液中產生白色沉淀。分析其原因,亦是因二者混合過程中放熱,HCl氣體將硫酸帶出,使其進入硝酸鋇溶液中產生白色沉淀。
在2019年北京卷中,Cu與濃硫酸在加熱條件下反應制備二氧化硫,生成的氣體通入硝酸銀溶液之前,用飽和亞硫酸氫鈉除去SO2中的雜質,其作用亦是除去可能被氣流帶出的硫酸。
三、對“異常現象”的教學思考
對實驗異常現象的應對和處理,是體現教學機智和專業素養的重要時刻。當學生因實驗異常現象產生認知沖突時,多會產生主動探究的欲望。教師可因勢利導,順勢而為,在解決沖突的過程中提升學生的認知水平和學科能力,幫助學生形成敢于質疑、勇于創新、崇尚真理和嚴謹求實的科學態度。當教師因實驗異常現象產生認知沖突時,應當有自覺探究的意識。平時教學中的意外實驗現象背后都隱藏著必然,嚴謹的科學態度是教師需要教會學生的珍貴品質。
【參考文獻】
[1]范樓珍,王艷,方維海.物理化學[M].北京:北京師范大學出版社,2009:131-165.
[2]陳兆先,高俊.初中化學恒沸現象探析——以加熱通有二氧化碳的石蕊溶液未能恢復紫色為例[J].化學教育,2019(11):79-81.
[3]應春曉.乙烯性質實驗的再改進[J].化學教學,2019(04):69-71.

