皮膚上的“生態系統”:皮膚微生物組
夏晶晶 鐘倩 魏情珍 王久存
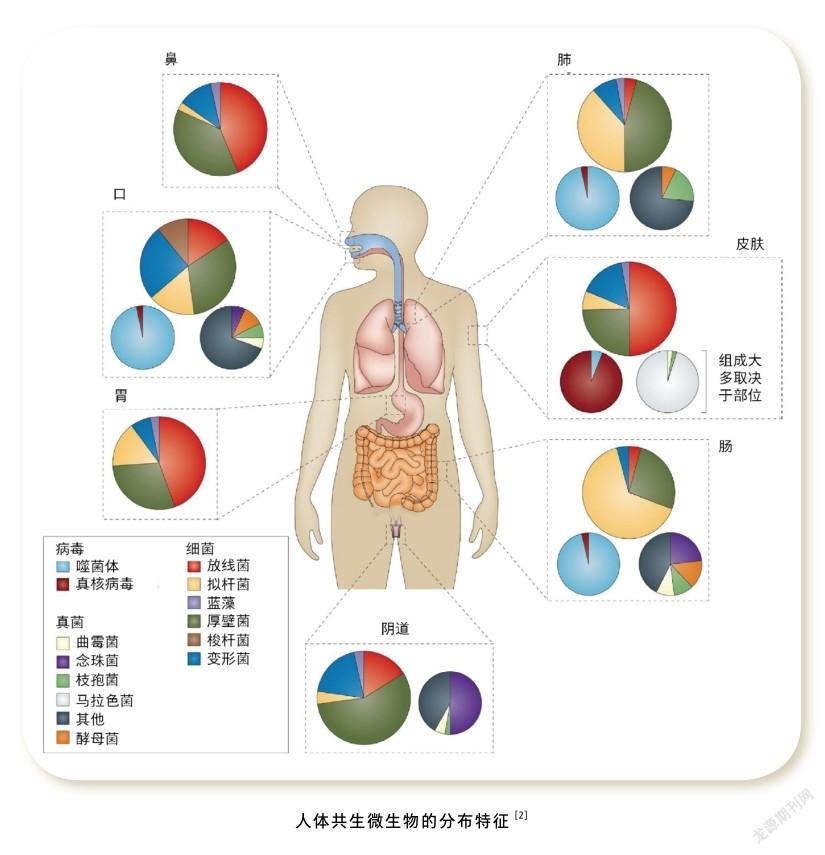
人類基因組計劃在2003年完成以后,科學家意識到解密人類自身基因組并不能完全解決疾病與健康的關鍵問題。人體表面和體內存在著數量巨大的共生微生物,它們與人體細胞數量大致相當,但其基因總數龐大,可達人類基因數目的幾百倍,而人類卻對這些共生微生物知之甚少。鑒于此,美國國立衛生研究院(NIH)于2007年底率先啟動 “人類微生物組計劃”(Human Microbiome Project, HMP),包括中國在內的十余個國家共同參與了這一國際大科學計劃。該研究計劃使用新一代測序技術對人體多個部位的共生微生物進行宏基因組測序,宏基因組測序是指對微生物群體進行高通量測序,分析特定環境中微生物群體的基因組成及功能、微生物群體的多樣性與豐度,進而分析微生物與環境、微生物與宿主之間的關系,發現具有特定功能的基因。HMP的目標是通過繪制人體共生微生物的宏基因組圖譜,解析微生物對人類健康的影響。現在知道人體所有與外界環境有交流的器官,從口腔到腸道、從鼻腔到肺、男女生殖—泌尿系統、皮膚表面等,都有大量微生物的定殖(colonization),即來自不同環境的微生物黏附在人體特定部位,進行生長、繁殖,它們形成大大小小、環境各異的“生態系統”,其組成和豐度均有顯著差異。
在如此多理化特征相差巨大的“生態系統”中,皮膚位于人體最外層,與外界環境接觸面積大、接觸時間長。那么這個“生態系統”,即“皮膚微生態”有哪些特征,與人體健康有怎樣的關聯,又與皮膚的日常維護有什么關系。
皮膚微生物與人體健康
皮膚微生物組(skin microbiota)對于維持宿主皮膚穩態、發揮皮膚的屏障功能有重要作用[1]。
抵抗病原微生物侵襲
皮膚上共生微生物的存在會導致其對皮膚上營養和空間的競爭,從而極大地影響病原微生物進入皮膚表面。這些常駐微生物可以直接或通過調控皮膚的角質形成細胞而間接分泌抗菌肽,以抵御外界病原菌定殖;還可分解角質細胞碎屑或脂質,輔助乳化皮脂膜,維持表皮酸性環境,以抵御外界病原菌定殖。
參與宿主免疫反應
皮膚常駐微生物與宿主之間不僅存在共生關系,還能激發宿主適當的保護性免疫反應,使宿主更強有力地對抗病原體的感染。在成年小鼠皮膚中,微生物的定殖可調控局部炎癥環境和免疫細胞的功能[3,4]。例如,無菌小鼠感染寄生病原體利什曼原蟲會導致寄生蟲的瘋狂生長和小鼠保護性免疫反應減弱,但隨著表皮葡萄球菌在無菌小鼠表面的定殖,這些不良反應會有所緩解。
維持表皮正常結構
通過對無菌小鼠和有菌小鼠背部皮膚的轉錄組學分析,發現差異表達基因功能除富集于免疫反應外,主要富集于表皮增殖與分化;小鼠皮膚組織染色實驗,亦進一步表明皮膚菌群對表皮增殖與分化有重要調節作用。
調節皮膚的損傷修復與再生
皮膚微生物組在皮膚修復和再生中發揮了重要作用。通過測試不同細菌負載下小鼠皮膚創面誘導毛囊新生的狀況,發現小鼠創面誘導毛囊新生能力與皮膚細菌數量呈正相關:無菌小鼠修復再生能力最低,而野生型小鼠最高[5];而人體實驗中局部使用廣譜抗生素會減緩人體皮膚傷口愈合。
生成活性代謝物調節皮膚健康
皮膚微生物組在皮膚表面合成具有活性的代謝產物,如短鏈脂肪酸、B族維生素等,調節皮膚生理功能。越來越多的研究顯示細菌代謝產物是菌群發揮生物學作用的重要組分,如某些細菌的色氨酸代謝產物吲哚-3-甲醛在特應性皮炎患者皮膚表面的含量會升高,吲哚-3-甲醛可激活芳香烴受體對朗格漢斯細胞產生負向調節作用,參與調節皮膚炎癥。
皮膚表面部分微生物能分解皮脂腺分泌的皮脂,產生游離脂肪酸,降低皮膚表面酸堿度,并與皮脂細胞來源的導管素、β-防御素和抗菌組蛋白共同控制微生物的定殖。皮膚上的頂泌汗腺能將其分泌物,由蛋白質、脂質和類固醇混合而成的油性、無味混合物,分泌到毛囊中,被常駐微生物降解,產生汗水的特征氣味。
我們通過宏基因組學研究,發現豐度最高的基因參與輔助因子和維生素的生物合成,這不僅對微生物的生長和生存至關重要,維生素的合成亦與皮膚健康緊密相關。比如在皮膚微生物組中發現的生物活性分子依克多因(ectoine)已應用于美白抗衰。
腸道微生物研究對皮膚微生物研究的啟發
腸道微生物(又稱腸道菌群)與宿主的相互作用研究較為廣泛和深入,可為皮膚菌群對宿主的作用研究帶來啟發。腸道微生物與宿主的作用并非單方向單線程:微生物對宿主產生的效應可改變宿主表型,同時新的宿主表型又反過來對微生物菌群產生反饋效應。如宿主飲食習慣及異源物質攝入(如藥物)可對腸道微生物的組成、基因表達產生影響,而腸道菌群代謝產物,如短鏈脂肪酸、氨基酸及其衍生物等可被宿主腸道吸收入血液,影響宿主多器官生理、病理等過程。這些代謝產物既能促進健康,也可能損害健康。微生物菌群及其宿主共同進化,可影響宿主,產生新的表型。
影響皮膚微生物組構成的因素
對于同一個體,皮膚微生物組具有時空穩定性;另一方面,皮膚微生物又極具個體差異性,多種內源或外源因素可對皮膚微生物造成影響,包括皮膚部位、皮膚腺體及相關理化性質、性別、年齡、地理位置和種族、環境暴露或污染等。
皮膚部位
根據不同皮膚部位的水油特性,皮膚主要分為油性、濕性、干性部位及足部。油性部位主要富集丙酸桿菌和馬拉色菌,濕性部位以丙酸桿菌和葡萄球菌為主。油性部位的微生物組成較穩定,而干性部位的微生物組成隨時間變化顯著。
皮膚腺體及相關理化性質
不同部位皮膚“零件”(如毛囊、汗腺、皮脂腺等)的差異造就了皮膚各自獨特的理化性質,如脂肪酸組成、酸堿度等,它們對生存其上的微生物產生了較大影響。

外泌汗腺通過分泌汗液影響皮膚酸堿度,影響微生物的定殖。皮脂腺與毛囊相連,能分泌富含脂質的油脂,在潤滑皮膚的同時發揮抗菌作用。皮脂腺相對缺氧,支持兼性厭氧菌的生長,如痤瘡丙酸桿菌(Cutibacterium acnes)能把皮脂中的甘油三酯水解成游離脂肪酸,游離脂肪酸有助于維持皮膚的酸性,從而抑制許多常見病原菌。
性別
由于自身生理因素(激素、皮脂、出汗率、皮膚厚度和毛發密度等)的差異和后天生活習慣(洗手頻率、護膚習慣)的不同,男性和女性的皮膚微生物組也有顯著差異。
年齡
嬰兒皮膚微生物的定殖取決于分娩方式和母親的皮膚菌群,但青春期時皮膚微生物會重新調整。青春期激素的增加可刺激產生大量油脂,有利于親脂性微生物的生長,如丙酸桿菌屬和馬拉色菌屬,因此青春期的皮膚菌群容易失衡而導致痤瘡等皮膚問題。青春期過后,皮膚菌群會重新恢復到相對穩定的狀態。隨著年齡增加,皮膚呈現老化特征,如色斑變多,皮膚變黃,皺紋變多,表皮厚度增加,氣味生成等,這些都與皮膚微生物密切相關。
地理位置和種族
來自不同國家地區、種族甚至海拔的人群的皮膚微生物組也不盡相同。我們近期一項研究發現,中國人群及新加坡人群皮膚中富集一種微生物——奧斯陸莫拉菌(Moraxella osloensis),但它在北美人群中較少出現。
環境污染
皮膚是人體與外界環境接觸面積最大、接觸時間最長的器官,環境中的顆粒物和生物成分對皮膚微生態的影響最顯而易見。例如,多環芳烴作為一種環境污染物,可導致面部老化、內分泌失調,長期暴露會導致皮膚微生物菌群結構發生變化。
皮膚微生態失衡會導致皮膚疾病
越來越多的研究表明,皮膚微生態失衡(又稱菌群失衡)會導致一系列皮膚疾病,如特應性皮炎、痤瘡、脂溢性皮炎、銀屑病、機會性感染等[7]。
特應性皮炎與金黃色葡萄球菌
特應性皮炎是一種慢性復發性皮膚疾病,多在兒童期發病,患病率可高達20%,表現為劇烈瘙癢,嚴重影響患者生活質量。90%以上的患者在病變和非病變皮膚上都定殖了金黃色葡萄球菌,而在健康個體中該菌的定殖比例低于5%,當患者病情好轉時金黃色葡萄球菌的相對豐度就有所降低。
痤瘡與痤瘡丙酸桿菌
許多人在青春期受到過“青春痘”的困擾,“青春痘”就是痤瘡,是一種最常見的皮膚病。痤瘡可影響多達80%的青少年,并持續存在于約3%的中年人中。痤瘡的致病因素主要涉及四個方面:皮脂分泌增加、濾泡表皮過度角質化、痤瘡丙酸桿菌定殖和炎癥[8]。在健康人和痤瘡患者都有痤瘡丙酸桿菌的定殖,但痤瘡丙酸桿菌的基因表達譜在兩類人群中存在顯著差別,且不同痤瘡丙酸桿菌菌株有不同的毒力,在健康皮膚和痤瘡患者皮損中的分布和豐度也不同,如痤瘡丙酸桿菌的亞種1A1 型與痤瘡相關。

脂溢性皮炎與馬拉色菌
脂溢性皮炎是一種炎癥性、增生性、瘙癢性皮膚病,特征是皮膚發紅并呈片狀,通常會影響頭皮。以真菌為靶點的抗菌藥物能有效對抗脂溢性皮炎,而抗細菌藥物則不能緩解疾病發生,馬拉色菌屬作為皮膚真菌的主要組成部分,廣泛存在于頭皮部位,推測馬拉色菌屬參與了疾病的發生。已發現脂溢性皮炎的改善與頭皮上馬拉色菌減少有關。推測疾病發生與馬拉色菌的脂肪酶基因相關,該酶能降解皮脂產生的游離脂肪酸代謝物(如油酸),而這些代謝物可滲透至皮膚上層,促進皮膚過度增生和發生炎癥。
銀屑病
銀屑病是一種免疫介導的炎癥性皮膚病,全球有1%~3%人口受到影響。以往研究表明,皮膚微生物群落的生態失衡與多種炎癥和自身免疫性疾病有關。有研究表明,銀屑病患者皮膚上的微生物群落與健康皮膚上的有很大不同,銀屑病皮膚微生物組的多樣性增加,但穩定性降低。群落穩定性的喪失及表皮葡萄球菌和痤瘡丙酸桿菌等免疫調節細菌的減少,可能導致金黃色葡萄球菌等病原體的定殖增多,加劇皮膚炎癥。
機會性感染
盡管皮膚共生微生物通常和平地棲息在宿主體內,但許多微生物在特定環境下具有引起感染的能力。表皮葡萄球菌具有許多有益作用,但它仍是感染的常見原因,尤其是涉及留置醫療器械(如導管)的院內深部組織感染。此外,在正常皮膚微生物組中發現的許多細菌經常導致慢性、不愈合傷口感染,通常發生在糖尿病患者和老年人中。
皮膚型
皮膚微生態具有極大的個體差異性。基于北美人群及中國漢族人群的大規模宏基因組學研究,均提示皮膚微生物組具有極強的個體差異性,即人與人之間的皮膚微生物組成差異性極大,甚至有人提出“皮膚微生物指紋”的概念。面對如此復雜的多樣性,如何實現個性化精準干預?我們從“腸道菌群”研究中找到了“靈感”——群體分型(stratification)。皮膚菌群和腸道菌群一樣,都是不可見且不能被傳統方法測量的新興表型,通過研究分析多個表型數據的集合(表型組),可有效描述微生物群落結構的主要特征,并對臨床有積極指導作用。
研究發現,皮膚微生物在中國人群的群體水平存在兩種穩定的群落組成模式,命名為“皮膚型”(cutotypes),分別是以奧斯陸莫拉菌為主導的M型皮膚(M-cutotype)和以痤瘡丙酸桿菌為主導的C型皮膚(C-cutotype)[10]。兩種皮膚型具有不同的微生物網絡特征和基因功能富集:C型皮膚微生物群落富集碳水化合物和甾醇代謝、脂肪酸合成等,M型皮膚微生物富集氨基酸、芳香族化合物代謝、耐藥性等;宿主皮膚狀態也顯示出明顯差異,C型皮膚水分油脂含量高,以年輕人居多,M型皮膚水分油脂含量偏低,膚色暗沉偏黃,以老年人居多。兩種“皮膚型”好似兩個相對獨立的微生物穩態,如果通俗地類比于其他“生態系統”:即是不同 “土壤”(皮膚型)選擇了適合各自生長的“植被”(微生物),這些植被又可反過來影響土壤狀態。自此,可以清楚地看到“相互適應、精準匹配”對于皮膚上“生態系統”和諧發展非常重要。
基于皮膚型這一新的分型方式,將大大簡化微生物個體差異性的評估,方便人們抓住核心問題的主要差異特征,進而實現潛在的個性化診斷和精準干預。
[1]Chen Y E, Fischbach M A, Belkaid Y. Skin microbiota-host interactions. Nature, 2018, 553: 427-436.
[2]Marsland B J, Gollwitzer E S. Host-microorganism interactions in lung diseases. Nat Rev Immunol, 2014, 14: 827-835.
[3]Naik S, Bouladoux N, Wilhelm C, et al. Compartmentalized control of skin immunity by resident commensals. Science, 2012, 337: 1115-1119.
[4]Naik S, Bouladoux N, Linehan J L, et al. Commensal-dendriticcell interaction specifies a unique protective skin immune signature. Nature, 2015, 520: 104-108.
[5]Wang G, Sweren E, Liu H, et al. Bacteria induce skin regeneration via IL-1beta signaling. Cell Host Microbe, 2021, 29: 777-791.
[6]Boxberger M, Cenizo V, Cassir N, et al. Challenges in exploring and manipulating the human skin microbiome. Microbiome, 2021, 9: 125-139.
[7]Byrd A L, Belkaid Y, Segre J A. The human skin microbiome. Nat Rev Microbiol, 2018, 16:143-155.
[8]Choi C W, Choi J W, Park K C, et al. Facial sebum affects the development of acne, especially the distribution of inflammatory acne. J Eur Acad Dermatol Venereol, 2013, 27: 301-306.
[9]Brandwein M, Steinberg D, Meshner S. Microbial biofilms and the human skin microbiome. NPJ Biofilms Microbiomes, 2016, 2: 3-8.
[10]Li Z, Xia J, Jiang L, et al. Characterization of the human skin resistome and identification of two microbiota cutotypes. Microbiome, 2021, 9: 47-66.
關鍵詞:皮膚微生物組 菌群失衡 皮膚型 表型組 ■

