核心素養(yǎng)理念下的高中化學(xué)教學(xué)設(shè)計(jì)
曾祥軍
摘要:離子平衡知識(shí)與化學(xué)平衡知識(shí)密切相關(guān),尤其是化學(xué)平衡的建立和平衡移動(dòng)原理等知識(shí)及其學(xué)習(xí)方法,可直接用來指導(dǎo)對(duì)離子平衡的學(xué)習(xí)。因此,離子平衡是化學(xué)平衡學(xué)習(xí)的繼續(xù)與拓展。對(duì)電離平衡、水解平衡和溶解平衡的掌握,是對(duì)中學(xué)化學(xué)的平衡理論體系的豐富和完善。本章是高中化學(xué)的重要內(nèi)容之一,是中學(xué)化學(xué)基礎(chǔ)理論的一個(gè)重要部分,也是學(xué)生整個(gè)中學(xué)階段的難點(diǎn)。本文以此為例,重點(diǎn)通過對(duì)水的電離的“宏觀辨識(shí)與微觀探析”及“證據(jù)推理”,實(shí)踐探索基于學(xué)科核心素養(yǎng)培養(yǎng)的高中化學(xué)課堂教學(xué)設(shè)計(jì)。
關(guān)鍵詞:高中化學(xué)? 教學(xué)設(shè)計(jì)? ?核心素養(yǎng)
《普通高中化學(xué)課程標(biāo)準(zhǔn)(2017版)》指出,化學(xué)學(xué)科核心素養(yǎng)包括:宏觀辨識(shí)與微觀探析、變化觀念與平衡思想、證據(jù)推理與模型認(rèn)知、科學(xué)探究與創(chuàng)新意識(shí)、科學(xué)態(tài)度與社會(huì)責(zé)任等五個(gè)方面。[1]化學(xué)學(xué)科核心素養(yǎng)要做到真正的落實(shí),離不開全體化學(xué)教師的具體教學(xué)實(shí)踐,特別是在進(jìn)行課堂教學(xué)設(shè)計(jì)時(shí)要根據(jù)具體的知識(shí)內(nèi)容、采取適宜的教學(xué)方法、設(shè)計(jì)高效的學(xué)習(xí)活動(dòng),使學(xué)生在學(xué)習(xí)過程中形成必備的品格、關(guān)鍵能力和正確的價(jià)值觀念。本文以人教版《選擇性必修第一冊(cè)》第三章第二節(jié)“水的電離”為例,實(shí)踐探索基于學(xué)科核心素養(yǎng)培養(yǎng)的高中化學(xué)課堂教學(xué)設(shè)計(jì)。
一、“水的電離”教學(xué)設(shè)計(jì)
【情境引入】教師利用真實(shí)的情境引入,設(shè)計(jì)如下問題:干的木材不導(dǎo)電,為什么濕的木材會(huì)導(dǎo)電?通過問題激發(fā)學(xué)生的學(xué)習(xí)興趣,引導(dǎo)學(xué)生回顧生活中與水電離相關(guān)的知識(shí),提出疑問:濕的木材導(dǎo)電是否與水的電離平衡有關(guān)?
核心活動(dòng)一:通過宏觀辨識(shí)與微觀探析,初步建立水中存在電離平衡的概念。
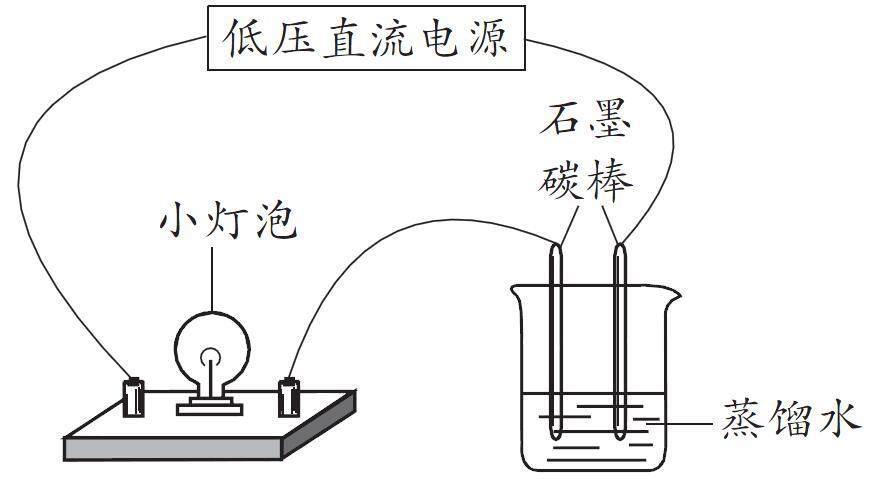
【實(shí)驗(yàn)1】用干電池、小燈泡(帶燈座)以及導(dǎo)線、純水按照如下圖組裝成一個(gè)串聯(lián)電路。觀察現(xiàn)象:小燈泡不發(fā)光,說明純水幾乎不導(dǎo)電。
【實(shí)驗(yàn)2】將實(shí)驗(yàn)1裝置中的純水換成礦泉水,觀察現(xiàn)象,發(fā)現(xiàn)小燈泡發(fā)出微弱的光。
【實(shí)驗(yàn)3】將實(shí)驗(yàn)1裝置中的小燈泡換成靈敏電流計(jì),觀察現(xiàn)象,發(fā)現(xiàn)靈敏電流計(jì)發(fā)生了微弱的偏轉(zhuǎn)。
【學(xué)生討論】學(xué)生討論觀察到的現(xiàn)象,并分析得出結(jié)論,水分子發(fā)生了微弱的電離,水是一種弱電解質(zhì)。
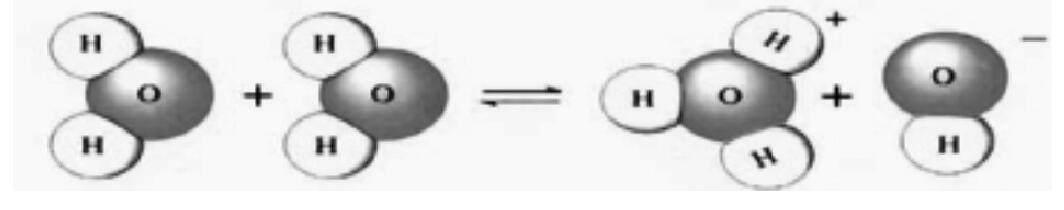
【講解】水分子在運(yùn)動(dòng)中發(fā)生了相互碰撞,其中有極少部分的水分子通過碰撞生成了H3O+和OH-,H3O+和OH-又可反應(yīng)生成了H2O。
【板書】1.水的電離:H2O+H2O[] H3O+ +OH-
通常表示為:H2O[]H++OH-
核心活動(dòng)二:通過宏觀辨識(shí)與微觀探析,證據(jù)推理,學(xué)生自主探究水的電離。
【提出問題】實(shí)驗(yàn)測(cè)定,在25℃時(shí),1L純水(其物質(zhì)的量為55.6mol)中只有1×10-7mol的H2O發(fā)生電離。可見水的電離是非常微弱的。此時(shí),c(H+)、c(OH-)各為多少?c(H+)、c(OH-)有什么關(guān)系?
【學(xué)生回答】c(H+)=c(OH-)=1×10-7moL
【板書】25℃時(shí),純水中c(H+)=c(OH-)=1×10-7moL
【講解】在25℃時(shí),c(H+)·c(OH-)=1×10-14,在一定溫度下,c(H+)和c(OH-)的乘積為一個(gè)常數(shù),這一常數(shù)叫做水的離子積,用Kw表示。
【板書】水的離子積:在一定溫度時(shí),c(H+)和c(OH-)的乘積為一常數(shù),用Kw表示。
即Kw=c(H)·c(OH)。Kw為水的離子積常數(shù),簡(jiǎn)稱為水的離子積。25℃時(shí),Kw=c(H)·c(OH)=1×10-14。
【設(shè)計(jì)意圖】引導(dǎo)學(xué)生對(duì)水的電離由定性認(rèn)識(shí)上升到定量認(rèn)識(shí),從微觀角度分析水的電離。
【提問】水的電離與什么因素有關(guān)。
【學(xué)生回答】電離是吸熱過程,水的電離也是電離的一種,因此也是吸熱反應(yīng)。
【提問】升溫時(shí),促進(jìn)? ? ? (填“促進(jìn)”或“抑制”)水的電離,c(H+)和c(OH-)增大,Kw 增大。如100℃時(shí),1L水中有1×10-6mol的H2O發(fā)生電離,此時(shí),Kw=c(H+)·c(OH-)=1×10-12。
【歸納總結(jié)】水的電離是吸熱過程,溫度升高,Kw增大。
【拓展歸納】水的離子積是水電離平衡時(shí)的性質(zhì),它不僅適應(yīng)純水,也適應(yīng)于酸、堿、鹽溶液中。當(dāng)溫度不變時(shí),實(shí)驗(yàn)測(cè)得Kw不變。如25℃時(shí),c(H+)溶液=c(OH-)溶液=1×10-7,即:c(H+)·c(OH-)=1×10-14。
【分析】H2O[]H++OH-,當(dāng)向水中加入H+時(shí),水的電離受到抑制,水的電離平衡受到破壞,然后又建立了新的電離平衡,此時(shí)c(H+)比原來增大,而c(OH-)比原來減小,但實(shí)驗(yàn)測(cè)得,只要溫度不變,c(H+)·c(OH-)不變,即Kw不變。
【板書】Kw的影響因素:只隨溫度的改變而改變,與溶液的酸堿性無關(guān)。
【提問】影響Kw的因素是溫度,那么,影響水電離的因素是什么?
【學(xué)生回答】根據(jù)上面的分析,可以發(fā)現(xiàn)影響水電離的因素是溫度以及酸與堿。
【板書】影響水電離的因素
(1)溫度:因?yàn)樗碾婋x是吸熱過程,升溫時(shí),促進(jìn)水的電離。(2)溶液的酸堿度:溶液呈酸性或堿性時(shí),水的電離程度減弱。
二、教學(xué)反思
本文嘗試基于“宏觀辨識(shí)與微觀探析”“證據(jù)推理與模型認(rèn)知”等化學(xué)學(xué)科核心素養(yǎng)培養(yǎng)的課堂教學(xué)設(shè)計(jì)。依托水的電離平衡,通過宏觀辨識(shí)物質(zhì)的形態(tài)及變化現(xiàn)象,從微觀層面理解水的電離及影響電離平衡的因素;通過設(shè)計(jì)有針對(duì)性的問題,組織學(xué)生自主學(xué)習(xí),逐步樹立推理意識(shí),能基于證據(jù)對(duì)水的電離進(jìn)行分析,并通過分析推理加以證實(shí);培養(yǎng)學(xué)生的分析、歸納、推理能力、實(shí)驗(yàn)?zāi)芰Α2]
參考文獻(xiàn):
[1]中華人民共和國教育部.普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)[S].北京:人民教育出版社,2018(01):18-21.
[2]王秀紅,李志航,張冬華.發(fā)展學(xué)生化學(xué)學(xué)科核心素養(yǎng)的“化學(xué)能與電能”教學(xué)[J].化學(xué)教育(中英文),2020(03):27-32.

