基于守恒思想的化學(xué)問題的解決策略
摘 要:守恒思想是認(rèn)識(shí)化學(xué)、學(xué)習(xí)化學(xué)的基本思想觀念之一.同時(shí),守恒思想還是一種非常重要的解題思想,將其應(yīng)用到化學(xué)解題中,可開闊學(xué)生的思維、拓展解題思路,進(jìn)而促使學(xué)生快速、準(zhǔn)確地解答常見的化學(xué)問題.因此文章基于化學(xué)守恒思想的內(nèi)涵,圍繞其在日常解題中的具體應(yīng)用展開了探究.
關(guān)鍵詞:守恒思想;問題解答;核心素養(yǎng);初中化學(xué)
中圖分類號(hào):G632 文獻(xiàn)標(biāo)識(shí)碼:A 文章編號(hào):1008-0333(2023)29-0128-03
收稿日期:2023-07-15
作者簡介:成果(1983.3-),女,本科,中學(xué)一級(jí)教師,從事化學(xué)教學(xué)研究.
守恒思想是學(xué)生認(rèn)識(shí)化學(xué)、學(xué)習(xí)化學(xué)時(shí)的基本觀念之一.顧名思義,守恒就是物質(zhì)在發(fā)生變化時(shí),或者兩種物質(zhì)在發(fā)生作用時(shí),某物理量保持不變.在化學(xué)學(xué)習(xí)中,守恒思想是化學(xué)變化過程中永恒的主題,主要包括:化學(xué)反應(yīng)前后物質(zhì)總質(zhì)量的守恒現(xiàn)象、電解質(zhì)溶液中陰離子和陽離子帶電總數(shù)相平衡、氧化還原反應(yīng)中得失電子的總量守恒等.守恒思想不僅僅是學(xué)生學(xué)好化學(xué)的重要思想,也是解決化學(xué)問題的重要思想.在解題實(shí)踐中,學(xué)生唯有深刻理解這一化學(xué)思想,才能輕松化解各種難題,不斷提升初中生的化學(xué)解題能力.
1 守恒思想在初中化學(xué)解題中的應(yīng)用
1.1 質(zhì)量守恒與化學(xué)解題
質(zhì)量守恒是初中化學(xué)守恒思想中最為重要的組成,主要是指化學(xué)反應(yīng)過程中,反應(yīng)物和生成物之間的總體質(zhì)量不會(huì)發(fā)生改變,依然是相等的.在解答化學(xué)問題時(shí),利用這一守恒思想可對(duì)某種物質(zhì)的組成元素、化學(xué)式進(jìn)行推斷,還可以基于參與反應(yīng)的化學(xué)元素種類,推斷其反應(yīng)之后的物質(zhì)組成.
例1 將3.0 g的物質(zhì)放在氧氣中進(jìn)行充分燃燒,經(jīng)實(shí)驗(yàn)檢測得出生成二氧化碳8.8 g、水5.4 g,那么該物質(zhì)一共含有哪些元素?
解析 在解答本題目時(shí),關(guān)鍵在通過守恒思想對(duì)化學(xué)反應(yīng)前后元素守恒進(jìn)行判斷.在本題目中,經(jīng)過化學(xué)反應(yīng)之后生成了二氧化碳和水,即:化學(xué)反應(yīng)之后生成的物質(zhì)元素主要有C、H、O三種.根據(jù)守恒思想得出,在化學(xué)反應(yīng)之前,由于氧氣中含有氧元素,因此參與化學(xué)反應(yīng)的物質(zhì)中必然含有C、H兩種元素,也可能含有O元素.
之后,基于守恒思想,運(yùn)用計(jì)算的方式,得出二氧化碳中C元素的質(zhì)量為8.8 g×12/44×100 % =2.4 g,水中H元素的質(zhì)量為5.4 g×2/18×100 % =0.6 g.則C、H兩種元素質(zhì)量和為2.4 g+0.6 g=3.0 g.根據(jù)守恒思想得知,該物質(zhì)的質(zhì)量恰恰為3.0 g.由此可見,其中并不含有O元素,只有C與H兩種元素[1].
例2 某學(xué)生取26 g的氯化鋇溶液,將其置于試管中,向其中滴加了未知量分?jǐn)?shù)的稀硫酸溶液24.5 g,經(jīng)充分化學(xué)反應(yīng)之后,共得到沉淀物23.3 g,則化學(xué)反應(yīng)之后溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)為多少?
解析 在解答本題目時(shí),學(xué)生常常會(huì)受到“未知質(zhì)量分?jǐn)?shù)的稀硫酸溶液”的影響,導(dǎo)致其解題時(shí)思路受限.其實(shí),只要運(yùn)用質(zhì)量守恒思想,即可建立等量關(guān)系,進(jìn)而完成題目的解答.
根據(jù)題目得知:
BaCl2+H2SO4===BaSO4↓+2HCl
假設(shè)生成物質(zhì)HCl的質(zhì)量為x,則有233∶73=23.3 g∶x,計(jì)算得出x=7.3 g.
根據(jù)質(zhì)量守恒思想得出,化學(xué)反應(yīng)之后溶液的中質(zhì)量=化學(xué)反應(yīng)前各個(gè)物質(zhì)的總質(zhì)量-沉淀質(zhì)量,即:26.5 g+24.5 g-23.3 g=27.7 g.
因此,所求的溶質(zhì)質(zhì)量分?jǐn)?shù)為:
7.3 g/27.7 g×100%=26.4 %
1.2 原子守恒與化學(xué)解題
原子守恒是初中化學(xué)守恒思想的重要組成,主要是指化學(xué)變化前后,原子的數(shù)目、種類、質(zhì)量之間并未發(fā)生改變.同時(shí),原子守恒還是解決化學(xué)問題的重要手段,通過這一守恒思想和定律,可對(duì)化學(xué)方程式進(jìn)行配平,或者確定物質(zhì)化學(xué)式,也可基于化學(xué)反應(yīng)前后原子個(gè)數(shù)不變的條件,對(duì)未知物質(zhì)的原子個(gè)數(shù)比將該物質(zhì)化學(xué)式推斷出來.
例3 完成下列化學(xué)方程式:
5KI+KIO3+3H2SO4===3______+3K2SO4+3H2O
解析 針對(duì)這一題目,只要利用原子守恒思想,即可根據(jù)化學(xué)反應(yīng)前后元素種類守恒的定理,輕松將其推斷出來.在本題目中,由于反應(yīng)之前含有5種元素,即:K、I、H、S、O,
化學(xué)反應(yīng)之后則含有4種化學(xué)元素,即:K、H、S、O;同時(shí),從化學(xué)反應(yīng)前后原子的個(gè)數(shù)上來說,化學(xué)反應(yīng)之前I的原子個(gè)數(shù)為6,反應(yīng)后系數(shù)為3,因此化學(xué)反應(yīng)中未知物質(zhì)為I2,即:
5KI+KIO3+3H2SO4===3I2+3K2SO4+3H2O[2]
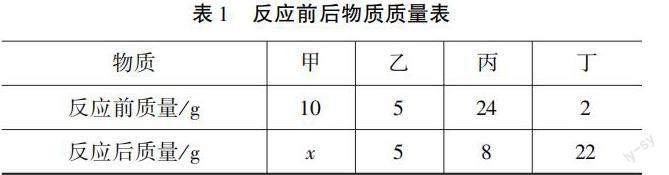
例4 在一個(gè)密封的容器中,盛有四種物質(zhì),分別為甲、乙、丙、丁.這四種化學(xué)物質(zhì)在一定的條件下,經(jīng)過了充分地化學(xué)反應(yīng).化學(xué)反應(yīng)前后,這四種物質(zhì)的質(zhì)量見表1.求:
(1)x為多少?
(2)如果物質(zhì)甲和物質(zhì)丙相對(duì)應(yīng)的分子量比為8∶16,則物質(zhì)甲和物質(zhì)丙化學(xué)計(jì)量系數(shù)比為多少?
(3)已知該化學(xué)反應(yīng)的化學(xué)方程式為:
甲+2丙===2丁
且甲的化學(xué)式為A2,丙的化學(xué)式為B2C2,則丁的化學(xué)式為什么?
解析 (1)根據(jù)圖表分析得出,物質(zhì)丙在化學(xué)反應(yīng)前后,質(zhì)量出現(xiàn)了減少的現(xiàn)象,則由此可判定該物質(zhì)為反應(yīng)物;同理,可判定出物質(zhì)丁為生成物;在化學(xué)反應(yīng)中,物質(zhì)乙的質(zhì)量并未發(fā)生改變,由此可斷定其為催化劑;而針對(duì)物質(zhì)甲來說,則可結(jié)合守恒思想中化學(xué)反應(yīng)前后質(zhì)量不變的原則,判斷出:甲+丙===丁,即可得出x的值為6 g.
(2)在這一問題中,根據(jù)守恒思想,假設(shè)物質(zhì)甲、丙、丁的化學(xué)計(jì)量系數(shù)為x、y、z,則物質(zhì)甲、物質(zhì)丙的變化量分別為4、16 g,則有:
x甲+y丙===z丁
即:8x∶16y=4 g∶16 g,則x∶y=1∶2
(3)針對(duì)這一問題,可利用原子守恒的思想進(jìn)行推斷.在化學(xué)反應(yīng)之前,存在A、B、C三種元素,則化學(xué)反應(yīng)之后也必然存在這三種元素.同時(shí),化學(xué)反應(yīng)之前,元素A中含有2個(gè)原子,元素B中含有4個(gè)原子,元素C中含有4個(gè)原子.根據(jù)原子守恒思想得知,化學(xué)反應(yīng)之后原子數(shù)目應(yīng)保持不變,因?yàn)樵囟≈暗南禂?shù)為2,則可推斷出物質(zhì)丁的化學(xué)式為AB2C2,或者A(BC)2[3].
1.3 電荷守恒與化學(xué)解題
電荷守恒也是初中化學(xué)守恒思想的重要組成,且這一類問題常常出現(xiàn)在溶液中.因?yàn)樵诟黝惢瘜W(xué)溶液中,存在大量的肉眼不可見的離子,且這些離子絕大多數(shù)都屬于陰陽離子.在這些離子中,陰陽離子的數(shù)量不一定相等,但是陰陽離子所帶的正電荷、負(fù)電荷總數(shù)卻是相等的.鑒于此,通過電荷守恒思想可有效解答化學(xué)溶液離子比例類型的題目中.
例5 已知某化學(xué)溶液中,含有四種離子:Na+、Mg2+、Cl-、SO2-4,其中離子個(gè)數(shù)比例關(guān)系n(Na+)∶n(Mg2+)∶n(Cl-)=4∶5∶8,假設(shè)鈉離子的個(gè)數(shù)為4n,則SO2-4的個(gè)數(shù)為多少?
解析 本題只要結(jié)合電荷守恒思想,即可從“溶液中陽離子中所帶有正電荷的數(shù)量與陰離子中所帶負(fù)電荷總量相等”出發(fā),假設(shè)SO2-4的個(gè)數(shù)為x個(gè),根據(jù)電荷的守恒關(guān)系,即可得出:1×4n+2×5n=1×8n+2x,則x=3n[4].
2 基于化學(xué)守恒思想解題教學(xué)啟示與解題注意事項(xiàng)
2.1 教學(xué)啟示
化學(xué)守恒思想雖然在教材上占據(jù)的篇幅比較少,但是該化學(xué)思想?yún)s在解題中發(fā)揮著十分重要的價(jià)值.鑒于此,初中化學(xué)教師在日常教學(xué)中,應(yīng)立足于守恒思想的內(nèi)涵,優(yōu)化課堂教學(xué)方案,促使學(xué)生在日常學(xué)習(xí)中逐漸掌握這一解題技能.一方面,堅(jiān)持循序漸進(jìn)的原則,引導(dǎo)學(xué)生完成化學(xué)守恒思想的深度理解,并借助從簡到難的訓(xùn)練中,逐漸掌握守恒思想解題的技巧;另一方面,還應(yīng)精心挑選經(jīng)典的習(xí)題,為學(xué)生進(jìn)行精講,使其在掌握守恒思想解題技能的同時(shí),形成運(yùn)用守恒思想解題的意識(shí).同時(shí),還應(yīng)在教學(xué)中,有意識(shí)地帶領(lǐng)學(xué)生進(jìn)行分類、歸納,使其真正掌握守恒思想的內(nèi)涵.
2.2 注意事項(xiàng)
守恒思想在初中化學(xué)解題中,雖然具備十分廣泛的應(yīng)用,但也存在一定的應(yīng)用范圍.學(xué)生在運(yùn)用守恒思想解題時(shí),還應(yīng)注意以下三個(gè)問題.
第一,明確守恒思想的應(yīng)用范圍和條件.化學(xué)守恒思想具備一定的適應(yīng)條件,切忌忽視題目條件,隨意應(yīng)用到任何題目中.甚至部分學(xué)生由于對(duì)其理解不夠深刻,隨意引申到分子數(shù)守恒、體積守恒等,進(jìn)而錯(cuò)誤運(yùn)用到相關(guān)題目中.鑒于此,在日常教學(xué)中,應(yīng)加深理論知識(shí)教學(xué),使學(xué)生明確守恒思想的適用條件,避免學(xué)生出現(xiàn)錯(cuò)用、亂用的現(xiàn)象.
第二,明確化學(xué)物質(zhì)反應(yīng)前后變化,關(guān)注化學(xué)反應(yīng)前提.在運(yùn)用守恒思想解答問題之前,必須要對(duì)題目進(jìn)行認(rèn)真分析,結(jié)合化學(xué)反應(yīng)前后物質(zhì)的變化和反應(yīng)前提,思考是否可以運(yùn)用這一思想進(jìn)行解題.例如,氫氣和氧氣沒有完全反應(yīng)的題目中,如果學(xué)生忽視前提條件,肆意運(yùn)用質(zhì)量守恒思想,就會(huì)導(dǎo)致解題錯(cuò)誤.
第三,注意化學(xué)反應(yīng)中是否存在氣體逸出的現(xiàn)象.在一些化學(xué)反應(yīng)中,不僅僅會(huì)產(chǎn)生新的物質(zhì),還會(huì)產(chǎn)生一定的氣體.鑒于此,在運(yùn)用守恒思想解題時(shí),如果忽視了化學(xué)反應(yīng)中所產(chǎn)生氣體的質(zhì)量,也會(huì)產(chǎn)生錯(cuò)誤.
第四,化學(xué)守恒思想存在于化學(xué)反應(yīng)中,而在部分化學(xué)題目中,不僅僅包括化學(xué)反應(yīng),還存在一定的物理變化.因此,學(xué)生在應(yīng)用該思想解答問題時(shí),必須要展開系統(tǒng)化的分析,做出精準(zhǔn)地判斷方可應(yīng)用[5].
綜上所述,守恒思想是化學(xué)學(xué)科的基本思想觀念,也是解答常見化學(xué)問題的重要途徑,通過質(zhì)量守恒、原子守恒和電荷守恒,可幫助學(xué)生打開相關(guān)題目的解題思路,輕松化解相關(guān)難題.鑒于此,化學(xué)教師在日常教學(xué)中,不僅僅要加強(qiáng)理論知識(shí)教學(xué),還應(yīng)傳授解題技能和方法,真正提升學(xué)生的化學(xué)解題能力.
參考文獻(xiàn):
[1] 王慶越.守恒思想在初中化學(xué)解題中的應(yīng)用[J].數(shù)理化解題研究,2022(23):113-115.
[2] 楊恩聘.初中化學(xué)解題中質(zhì)量守恒定律的有效應(yīng)用[J].課程教材教學(xué)研究(中教研究),2022(Z4):82-83.
[3] 沈玲玲.初中化學(xué)解題中質(zhì)量守恒定律的有效應(yīng)用[J].數(shù)理化解題研究,2020(17):84-85.
[4] 陳桂娣.質(zhì)量守恒定律在初中化學(xué)解題中的運(yùn)用[J].數(shù)理化解題研究,2020(08):95,101.
[5] 林秋香.淺談守恒定律在初中化學(xué)解題中的運(yùn)用[J].中小學(xué)教學(xué)研究,2016(12):26-27,30.
[責(zé)任編輯:季春陽]
- 數(shù)理化解題研究·初中版的其它文章
- 淺析初中數(shù)學(xué)教學(xué)中問題導(dǎo)學(xué)的應(yīng)用策略
- 基于智慧環(huán)境下初中數(shù)學(xué)總復(fù)習(xí)課的教學(xué)思考
- 新課標(biāo)理念下的概念教學(xué)
- 基于理解的初中數(shù)學(xué)逆向教學(xué)設(shè)計(jì)
- 虛擬實(shí)驗(yàn)在農(nóng)村初中化學(xué)實(shí)驗(yàn)教學(xué)中的應(yīng)用探究
- 從實(shí)驗(yàn)方法的角度引導(dǎo)學(xué)生自主設(shè)計(jì)實(shí)驗(yàn)

