“證據(jù)推理與模型認(rèn)知”素養(yǎng)導(dǎo)向的“沉淀溶解平衡”教學(xué)實(shí)踐與反思
劉臣 左京平
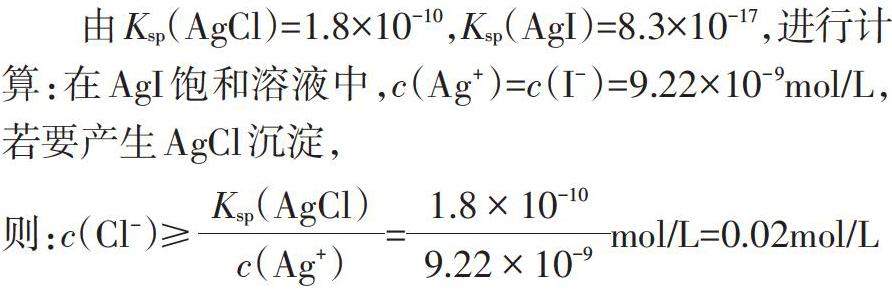
摘要:學(xué)科核心素養(yǎng)具有獨(dú)特的學(xué)科育人價值,基于化學(xué)概念原理知識的特點(diǎn)及其教學(xué)價值,闡述了依據(jù)理解和應(yīng)用學(xué)科素養(yǎng)框架開展沉淀溶解平衡主題教學(xué)設(shè)計的思路及策略。以促進(jìn)學(xué)生對沉淀轉(zhuǎn)化實(shí)質(zhì)的認(rèn)識為例,整合教材內(nèi)容為教學(xué)內(nèi)容,依托學(xué)科典型的學(xué)習(xí)方式開展探究教學(xué),著重發(fā)展學(xué)生“證據(jù)推理與模型認(rèn)知”的學(xué)科素養(yǎng),并進(jìn)行了教學(xué)反思。
關(guān)鍵詞:證據(jù)推理;模型認(rèn)知;科學(xué)探究;問題解決;教學(xué)設(shè)計
文章編號:1008-0546(2020)09-0063-05
中圖分類號:G632.41
文獻(xiàn)標(biāo)識碼:B
學(xué)科核心素養(yǎng)是指學(xué)生在經(jīng)歷對某一學(xué)科的學(xué)習(xí)后,逐步形成的該學(xué)科獨(dú)特的思想方法、基本觀念和思維方式,學(xué)科核心素養(yǎng)對學(xué)生的終身成長具有獨(dú)特的貢獻(xiàn)和育人價值。中學(xué)階段,教師通過課堂教學(xué),幫助學(xué)生后天習(xí)得某個學(xué)科的基本素養(yǎng),教師的角色從教書轉(zhuǎn)變?yōu)橛耍鸩綄?shí)現(xiàn)新時期育人目標(biāo)的跨越和升級。為此,基于培養(yǎng)學(xué)生學(xué)科素養(yǎng)引發(fā)的教學(xué)變革,廣大教育工作者展開了深入的思考和實(shí)踐。
一、問題的提出
化學(xué)概念原理知識是學(xué)生化學(xué)學(xué)習(xí)的重要內(nèi)容,承載著對物質(zhì)性質(zhì)、轉(zhuǎn)化及化學(xué)反應(yīng)的認(rèn)識功能與價值。在傳統(tǒng)的概念原理教學(xué)中,教師開展基于知識解析式的教學(xué),對概念涉及的內(nèi)涵和外延進(jìn)行知識點(diǎn)式的逐條分解、固化;以及應(yīng)用概念在解決“真實(shí)”問題中思維模板化、條目化,從而導(dǎo)致學(xué)生在學(xué)習(xí)概念原理時感覺“只見樹木、不見森林”,知識條目繁多,難于理解、難于記憶,更難于運(yùn)用。由此可見,在學(xué)生頭腦中并沒有形成結(jié)構(gòu)化的知識,自以為“掌握”的知識更不具有可遷移性。每當(dāng)遇到較為復(fù)雜的實(shí)際問題時,便無從下手,不能獨(dú)立操作且自覺調(diào)用所學(xué)知識去解決問題。
化學(xué)學(xué)科核心素養(yǎng)是學(xué)生在面對真實(shí)復(fù)雜的問題情境時所表現(xiàn)出來的關(guān)鍵能力和必備品格。當(dāng)學(xué)生在探究與創(chuàng)新實(shí)踐過程中遇到和發(fā)現(xiàn)問題時,需要調(diào)用原有模型,進(jìn)行假設(shè)推理、尋找證據(jù),并基于證據(jù)推理發(fā)現(xiàn)或建立新的模型。從這個意義上說,證據(jù)推理與模型認(rèn)知是科學(xué)探究與創(chuàng)新的思維核心,也是科學(xué)探究與創(chuàng)新的方法。據(jù)此,基于新課標(biāo)的課程理念,依據(jù)理解和應(yīng)用學(xué)科素養(yǎng)框架開展“沉淀溶解平衡”單元教學(xué)設(shè)計,以幫助學(xué)生從學(xué)習(xí)和理解“難溶電解質(zhì)在水溶液中存在沉淀溶解平衡”這一知識內(nèi)容出發(fā),基于知識載體設(shè)計有層次且具有挑戰(zhàn)性的學(xué)生活動,在探究中引導(dǎo)學(xué)生對實(shí)驗(yàn)現(xiàn)象和現(xiàn)象背后的原因進(jìn)行剖析、類比和歸納,提升學(xué)生對“沉淀的生成、溶解與轉(zhuǎn)化”實(shí)質(zhì)的認(rèn)識。在過程設(shè)計中突出發(fā)展學(xué)生“證據(jù)推理與模型認(rèn)知”的化學(xué)學(xué)科素養(yǎng),彰顯知識的素養(yǎng)發(fā)展價值。
二、教學(xué)內(nèi)容分析
1.課標(biāo)要求
《普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)》在選擇性必修課程模塊1化學(xué)反應(yīng)原理的主題3“水溶液中的離子反應(yīng)與平衡”內(nèi)容要求中指出:“認(rèn)識難溶電解質(zhì)在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解與轉(zhuǎn)化”。在學(xué)業(yè)要求中指出:“能用化學(xué)用語正確表示水溶液中的離子反應(yīng)與平衡,能通過實(shí)驗(yàn)證明水溶液中存在的離子平衡,能舉例說明離子反應(yīng)與平衡在生產(chǎn)、生活中的應(yīng)用”。此外,在學(xué)習(xí)活動建議中提出了“沉淀的轉(zhuǎn)化”實(shí)驗(yàn)及探究活動建議。
2.教材分析
“沉淀溶解平衡”隸屬于魯科版化學(xué)選擇性必修1第3章“物質(zhì)在水溶液中的行為”的第3節(jié),教學(xué)內(nèi)容包括沉淀溶解平衡與溶度積、沉淀溶解平衡的應(yīng)用。其中,教材著重討論了溶度積Ksp的相關(guān)概念以及如何通過比較溶度積與離子積Qc的相對大小,判斷難溶電解質(zhì)在給定條件下沉淀能否生成或溶解。教材對難溶電解質(zhì)溶解平衡的內(nèi)容呈現(xiàn),充分展示并承載著從微觀、動態(tài)、平衡的角度深入認(rèn)識物質(zhì)性質(zhì)、轉(zhuǎn)化及化學(xué)反應(yīng)的功能與價值,有助于發(fā)展學(xué)生對難溶電解質(zhì)溶于水及其變化的微觀本質(zhì)認(rèn)識,進(jìn)一步豐富和完善學(xué)生對離子反應(yīng)的理解。
3.對知識的深入分析
(1)學(xué)科大概念背景下知識的教學(xué)價值
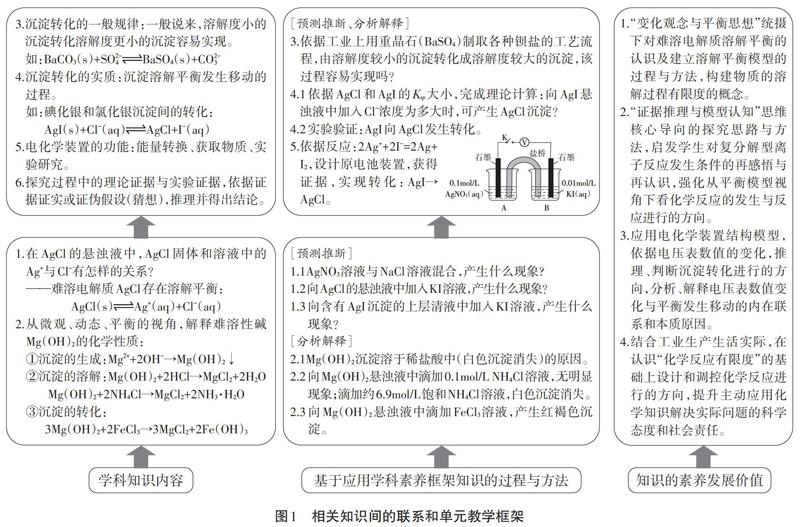
沉淀溶解平衡其核心內(nèi)容是探討難溶電解質(zhì)在其飽和溶液中的微觀、動態(tài)行為,發(fā)展學(xué)生對難溶物能否溶于水、生成沉淀的反應(yīng)能否真正進(jìn)行到底,以及在必修階段學(xué)習(xí)過的復(fù)分解型離子反應(yīng),如碳酸鈣與鹽酸的反應(yīng),兩種反應(yīng)物是否真正“交換成分”的進(jìn)一步認(rèn)識,其上位的學(xué)科大概念是化學(xué)平衡觀。發(fā)展學(xué)生從反應(yīng)有限度的平衡視角看沉淀的生成、溶解和轉(zhuǎn)化,認(rèn)識結(jié)果將不再單一和固化。與此同時,變化平衡的高認(rèn)知水平基礎(chǔ)是宏微結(jié)合。由此從三維目標(biāo)的發(fā)展上看,學(xué)生通過對難溶電解質(zhì)溶解平衡的學(xué)習(xí),不僅可以很好地經(jīng)歷“宏觀辨識與微觀探析”的辨識轉(zhuǎn)換過程,又能很好地體驗(yàn)和感悟“變化觀念與平衡思想”這一化學(xué)學(xué)科特征,學(xué)習(xí)過程是基于知識學(xué)習(xí)轉(zhuǎn)化為學(xué)科能力和素養(yǎng)的有力抓手。
(2)依據(jù)相關(guān)知識間的聯(lián)系設(shè)計教學(xué)
“沉淀溶解平衡”單元教學(xué)安排2課時完成:第1課時著重探討沉淀溶解平衡的建立過程,從宏觀、微觀、動態(tài)、定量的視角看AgCl懸濁液與KI溶液的反應(yīng),然后將其轉(zhuǎn)化為分析物質(zhì)性質(zhì)及其變化的思路和方法;進(jìn)而從溶解平衡的視角看Mg(OH)2的性質(zhì)與反應(yīng),為后續(xù)應(yīng)用核心知識解決較為復(fù)雜的實(shí)際問題打下基礎(chǔ)。第2課時學(xué)生在經(jīng)歷通過實(shí)驗(yàn)實(shí)現(xiàn)難溶物的生成與溶解的基礎(chǔ)上,重點(diǎn)探討沉淀轉(zhuǎn)化的方向問題,引導(dǎo)學(xué)生從理論分析和實(shí)驗(yàn)探究兩個維度,探討了兩組難溶物BaCO3和BaSO4、AgCl和Agl相互轉(zhuǎn)化的可行性。與此同時,在實(shí)驗(yàn)設(shè)計中借助學(xué)生在第1章學(xué)過的電化學(xué)原理,將不易觀察到的實(shí)驗(yàn)現(xiàn)象轉(zhuǎn)化為具有說服力且可觀測的電壓數(shù)據(jù),實(shí)現(xiàn)了概念原理知識間的融合,也著重培養(yǎng)學(xué)生“證據(jù)推理與模型認(rèn)知”的學(xué)科思維素養(yǎng)。其相關(guān)知識間的聯(lián)系和主題教學(xué)框架如下圖1所示。
三、學(xué)生學(xué)習(xí)情況分析
1.學(xué)生已有的認(rèn)知基礎(chǔ)
依據(jù)教材的學(xué)習(xí)順序,學(xué)生已經(jīng)學(xué)習(xí)了電解質(zhì)、氧化還原反應(yīng)和電化學(xué)等化學(xué)核心概念及相關(guān)模型;初步建立了對化學(xué)反應(yīng)的認(rèn)識角度:化學(xué)反應(yīng)的方向、速率、限度和能量。在本主題第1課時的學(xué)習(xí)中,已經(jīng)認(rèn)識到難溶電解質(zhì)在其飽和溶液中存在沉淀溶解平衡,通過改變外界條件可以調(diào)控反應(yīng)進(jìn)行的方向,即沉淀的生成、溶解與轉(zhuǎn)化現(xiàn)象。
2.學(xué)生學(xué)習(xí)本課的障礙點(diǎn)分析
學(xué)生學(xué)習(xí)本課遇到的困難與常出現(xiàn)的錯誤有:①對沉淀發(fā)生轉(zhuǎn)化的方向問題認(rèn)識片面。前測表明:班級2/3以上的學(xué)生普遍認(rèn)為BaSO4沉淀不能轉(zhuǎn)化為BaCO3,Agl沉淀也不能轉(zhuǎn)化為AgCl…即溶解度較小的沉淀不能轉(zhuǎn)化為溶解度較大的沉淀。②依據(jù)實(shí)驗(yàn)?zāi)康模谠O(shè)計實(shí)驗(yàn)方案尋找證據(jù)時,缺乏對獲得實(shí)驗(yàn)證據(jù)條件重要性的認(rèn)識,實(shí)驗(yàn)條件的改變將直接影響獲得證據(jù)的有效性,缺乏對證據(jù)的準(zhǔn)確性保持基本審慎的態(tài)度。③對電化學(xué)裝置模型的功能認(rèn)識不足,沒有打通概念原理相關(guān)知識間的聯(lián)系,缺乏對應(yīng)用所學(xué)知識分析并解決實(shí)際問題的角度與路徑。
四、基于理解和應(yīng)用學(xué)科素養(yǎng)框架的教學(xué)活動設(shè)計與實(shí)踐
1.基于工業(yè)生產(chǎn)實(shí)際問題引出課題
課堂引入,首先給出一則實(shí)際問題的背景資料:
重晶石(BaSO4)是自然界中含鋇元素的重要礦石,其難溶于水,且難溶于鹽酸、硝酸等強(qiáng)酸。以重晶石為原料制取各種鋇鹽的方法之一是將其轉(zhuǎn)化為可用鹽酸溶解的BaCO3。
查閱物質(zhì)在20℃時的溶解度數(shù)據(jù),S(BaCO3)=l.4×10-3g,S(BaSO4)=2.4×10-4g,引導(dǎo)學(xué)生關(guān)注將BaSO4轉(zhuǎn)化為BaCO3的過程,是溶解度較小的鹽轉(zhuǎn)化為溶解度較大鹽的過程,那么這種轉(zhuǎn)化容易實(shí)現(xiàn)嗎?其轉(zhuǎn)化的原理和依據(jù)又是什么呢?至此,完成了課堂引入一即發(fā)現(xiàn)問題的過程,引導(dǎo)學(xué)生關(guān)注應(yīng)用化學(xué)原理解決生產(chǎn)生活實(shí)際中的真實(shí)問題,也最大限度地承載了中學(xué)生社會責(zé)任的教育價值。
2.探究BaCO3和BaSO4間的相互轉(zhuǎn)化
在本環(huán)節(jié)中,教師圍繞“探究BaCO3和BaSO4間的相互轉(zhuǎn)化”,提出下述三個問題:
[問題1]設(shè)計實(shí)驗(yàn)方案,探究BaCO3和BaSO4間的相互轉(zhuǎn)化,并說明設(shè)計依據(jù)。
[問題2]通過收集何種證據(jù)(現(xiàn)象),證實(shí)BaCO3和BaSO4實(shí)現(xiàn)了相互轉(zhuǎn)化。
[問題3]結(jié)合沉淀溶解平衡原理,解釋說明沉淀發(fā)生轉(zhuǎn)化的原因。
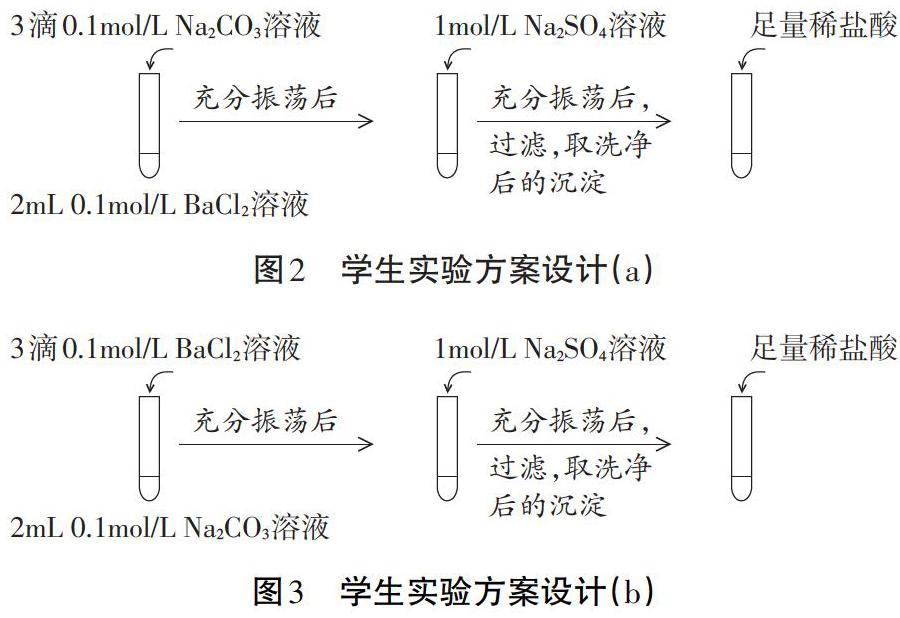
在分小組設(shè)計BaCO3和BaSO4相互轉(zhuǎn)化的實(shí)驗(yàn)方案中,學(xué)生能夠依據(jù)沉淀溶解平衡原理,先建立平衡再設(shè)計沉淀轉(zhuǎn)化的方向;通過檢驗(yàn)“反應(yīng)物消失”或“生成物存在”等實(shí)驗(yàn)證據(jù),證實(shí)沉淀發(fā)生了轉(zhuǎn)化,說明學(xué)生已經(jīng)具備了一定的證據(jù)意識。但在設(shè)計BaCO3轉(zhuǎn)化為BaSO4的實(shí)驗(yàn)方案中,呈現(xiàn)出如圖2,圖3所示的兩種方案:
兩種方案的不同之處在于建立BaCO3的溶解平衡狀態(tài)時,BaCl2與Na2CO3溶液的用量相對多少問題。此時教師及時抓住教學(xué)契機(jī),引導(dǎo)學(xué)生對兩組實(shí)驗(yàn)方案設(shè)計進(jìn)行反思和評價,啟發(fā)學(xué)生找到某種過量的試劑對后續(xù)實(shí)驗(yàn)造成的影響,以及判斷據(jù)此得到的實(shí)驗(yàn)現(xiàn)象能否作為可信的證據(jù)進(jìn)行推理。期間,進(jìn)一步強(qiáng)調(diào)實(shí)驗(yàn)證據(jù)的有效性及獲得實(shí)驗(yàn)證據(jù)條件的重要性,提醒學(xué)生在進(jìn)行證據(jù)推理時應(yīng)保持基本的審慎。
依據(jù)學(xué)生設(shè)計的方案,分小組完成BaCO3和BaSO4間的相互轉(zhuǎn)化,對假設(shè)進(jìn)行證實(shí)或證偽。通過觀察加入稀鹽酸后無明顯現(xiàn)象,證實(shí)BaCO3可全部轉(zhuǎn)化為BaSO4;對比加入稀鹽酸后產(chǎn)生少量氣泡,沉淀部分溶解,說明BaSO4部分轉(zhuǎn)化為BaCO3。通過對比實(shí)驗(yàn),使學(xué)生深刻體驗(yàn)和感悟沉淀轉(zhuǎn)化的過程性及差異性,為后續(xù)的理論分析打下基礎(chǔ)。
隨后討論問題3:結(jié)合沉淀溶解平衡原理,解釋說明沉淀發(fā)生轉(zhuǎn)化的原因。通過分析、歸納促使溶解平衡發(fā)生移動的因素及上述實(shí)驗(yàn)現(xiàn)象可知:溶解度小的沉淀轉(zhuǎn)化成溶解度更小的沉淀容易實(shí)現(xiàn),反之則不易。此環(huán)節(jié)引導(dǎo)學(xué)生初步建立現(xiàn)象證據(jù)和理論證據(jù)間的聯(lián)系,點(diǎn)撥學(xué)生基于證據(jù)進(jìn)行邏輯推理的分析角度和思維路徑。那么,對于溶解度相差較大的物質(zhì),其沉淀間的轉(zhuǎn)化是否能夠?qū)崿F(xiàn)呢?
3.Agl向AgCl發(fā)生轉(zhuǎn)化的可行性分析及實(shí)證
問題的提出激發(fā)了學(xué)生的探究欲望和興趣。隨后一些學(xué)生也疑惑起來,對由Agl沉淀向AgCl轉(zhuǎn)化的可行性提出質(zhì)疑,課堂上出現(xiàn)了兩種不同的聲音。此時,教師拋出兩個引導(dǎo)性問題啟發(fā)學(xué)生做進(jìn)一步思考:
[問題4]依據(jù)溶度積常數(shù),計算向Agl懸濁液中加入c(Cl-)為多大時,可產(chǎn)生AgCl沉淀。
[問題5]設(shè)計實(shí)驗(yàn)驗(yàn)證:Agl轉(zhuǎn)化為AgCl。
問題4要求學(xué)生結(jié)合AgCl和Agl的溶度積數(shù)據(jù),進(jìn)行理論推算,學(xué)生計算結(jié)果如下:
通過計算結(jié)果可知:若要產(chǎn)生AgCl沉淀,溶液中的c(Cl-)≥0.02mol/L時即可實(shí)現(xiàn),理論上此條件完全能夠達(dá)到,由此可得Agl也可以轉(zhuǎn)化為AgCl沉淀。但在實(shí)際操作中,向Agl懸濁液中加入飽和NaCl溶液,沉淀仍為黃色,始終未觀察到預(yù)期的白色AgCl沉淀。本環(huán)節(jié)利用理論證據(jù)與實(shí)驗(yàn)證據(jù)呈現(xiàn)出的相反結(jié)果制造思維沖突,促使學(xué)生深刻感受理論推演與實(shí)證的差異性,以及在真實(shí)情況下化學(xué)反應(yīng)的復(fù)雜性。
進(jìn)而引導(dǎo)學(xué)生尋找原因,再次回到反應(yīng)體系本身進(jìn)行分析。在Agl懸濁液中,溶液中的c(Ag+)已經(jīng)很小,即使生成AgCl,其物質(zhì)的量也很小;再加之AgCl為白色沉淀,受到黃色Agl沉淀的干擾和覆蓋,更難于觀察。為此,如何設(shè)計實(shí)驗(yàn),實(shí)現(xiàn)由Agl轉(zhuǎn)化為AgCl,并獲得有明顯可觀測的實(shí)驗(yàn)現(xiàn)象或證據(jù)呢?隨之教師繼續(xù)給出一組背景資料:
①查詢物質(zhì)的氧化還原性數(shù)據(jù)可知:2Ag++2I--I2+2Ag。
②其它條件不變時,參與原電池反應(yīng)的氧化劑(或還原劑)的氧化性(或還原性)越強(qiáng),原電池的電壓越大。
③離子的氧化性(或還原性)強(qiáng)弱與其濃度有關(guān)。
依據(jù)補(bǔ)充資料,進(jìn)一步啟發(fā)學(xué)生思考:Ag+可以氧化I-,能否依據(jù)氧化還原反應(yīng)的實(shí)質(zhì),將此反應(yīng)設(shè)計成原電池,通過改變物質(zhì)的濃度來改變其氧化(還原)性,進(jìn)而通過觀測電池兩電極間電壓的變化,說明Agl轉(zhuǎn)化為AgCl呢?隨后小組間圍繞實(shí)驗(yàn)設(shè)計展開了激烈地討論、分析和論證,設(shè)計出如下圖4所示的實(shí)驗(yàn)裝置及相關(guān)實(shí)驗(yàn)步驟。在師生間的對話中,教師重點(diǎn)要求學(xué)生闡明“為什么要這樣設(shè)計實(shí)驗(yàn)”及“哪些實(shí)驗(yàn)現(xiàn)象能夠支撐所得結(jié)論”,促使學(xué)生的思維完整而有序。
相關(guān)實(shí)驗(yàn)步驟及原理分析如下:
[步驟1]如圖連接裝置并加入試劑,閉合K,觀察并記錄電壓表讀數(shù)。
[步驟2]向盛有KI溶液的燒杯中不斷滴入AgNO3(aq),至不再產(chǎn)生黃色沉淀為止;由于發(fā)生反應(yīng):Ag++I-=Agl↓,導(dǎo)致c(I-)降低,還原性減弱,電壓表讀數(shù)減小。
[步驟3]再向盛有KI溶液的燒杯中加入一定量的NaCl固體,由于增大了溶液中c(Cl-),可使Agl(s)+Cl=AgCl(s)+I-正向移動,導(dǎo)致c(I-)增大,還原性增強(qiáng),電壓表讀數(shù)增大。
[步驟4]重復(fù)步驟1,再向盛有KI溶液的燒杯中加入與步驟3等量的NaCl固體,觀察并記錄電壓表讀數(shù)與步驟1相同,排除了加入的NaCl固體與AgNO3形成原電池對實(shí)驗(yàn)產(chǎn)生的影響。實(shí)驗(yàn)過程中電壓表的讀數(shù)變化如下圖5所示。
據(jù)此,可以通過觀測電壓表讀數(shù)的變化趨勢來證實(shí)AgI(s)+Cl-=AgCl(s)+I-沉淀轉(zhuǎn)化的發(fā)生。在本環(huán)節(jié)中,教師也潛移默化地教給學(xué)生實(shí)驗(yàn)方案設(shè)計的一般思路與方法——先理性分析,明確實(shí)驗(yàn)?zāi)康模僭O(shè)計方案進(jìn)行實(shí)證,最終得出結(jié)論。
4.課堂小結(jié)
本環(huán)節(jié)先由學(xué)生自行整理收獲與感悟,教師給予適當(dāng)點(diǎn)評和補(bǔ)充,也提升了課堂小結(jié)的起點(diǎn)。教師重點(diǎn)圍繞學(xué)生在本節(jié)課認(rèn)識發(fā)展上的提升和探究過程中證據(jù)推理思維模型的構(gòu)建進(jìn)行課堂小結(jié)。本課時探討物質(zhì)的溶解度大小與沉淀轉(zhuǎn)化方向間的關(guān)系問題,基于對沉淀轉(zhuǎn)化一般規(guī)律的認(rèn)知,圍繞由Agl(s)→AgCl(s)轉(zhuǎn)化這一核心問題開展實(shí)驗(yàn)探究,充分發(fā)揮電化學(xué)裝置的實(shí)驗(yàn)研究功能,提升學(xué)生對沉淀轉(zhuǎn)化實(shí)質(zhì)的認(rèn)識。課堂教學(xué)過程遵從開展科學(xué)探究過程的一般思路:從真實(shí)情境中確立問題一形成假設(shè)、拆解問題一實(shí)證法收集證據(jù)、分析問題一獲得結(jié)論,解決問題。在探究中,學(xué)生基于資料、數(shù)據(jù)和電化學(xué)裝置結(jié)構(gòu)模型進(jìn)行分析、推理,對假設(shè)進(jìn)行證實(shí)或證偽,逐步發(fā)展了學(xué)生的證據(jù)意識。
五、素養(yǎng)導(dǎo)向的教學(xué)實(shí)踐認(rèn)識與反思
1.精心設(shè)計教學(xué)環(huán)節(jié),依托探究活動提升證據(jù)意識
教育家杜威說,探究是“對任何一種信念或假設(shè)的知識進(jìn)行的積極、持續(xù)、審慎的思考”。在課堂教學(xué)中,逐步發(fā)展學(xué)生的證據(jù)意識,既要讓學(xué)生感受理論證據(jù)推導(dǎo)中的科學(xué)性,又要讓學(xué)生體驗(yàn)實(shí)驗(yàn)證據(jù)的過程性和復(fù)雜性,需要教師精心設(shè)計課堂上的學(xué)生活動環(huán)節(jié),堅持以開展科學(xué)探究的學(xué)習(xí)方式發(fā)展學(xué)生“證據(jù)推理與模型認(rèn)知”的學(xué)科素養(yǎng)。我們說,化學(xué)反應(yīng)是有一定規(guī)律的,但化學(xué)實(shí)驗(yàn)的結(jié)果又具有不確定性。例如在本課時中,學(xué)生通過理論計算得出,只需向AgI的懸濁液中加入0.02mol/L的NaCl溶液,即可實(shí)現(xiàn)Agl轉(zhuǎn)化為AgCl。但實(shí)驗(yàn)實(shí)證卻發(fā)現(xiàn),即使加入飽和NaCl溶液,也始終未觀察到AgCl白色沉淀的生成。開展教學(xué)設(shè)計時,教師有意識地設(shè)置了這樣的“沖突”環(huán)節(jié),理論證據(jù)和實(shí)驗(yàn)證據(jù)產(chǎn)生了“矛盾”,探究中獲取的證據(jù)錯了嗎?隨之引發(fā)學(xué)生對推理過程的再思考。設(shè)置學(xué)生分組研討,對探究中的證據(jù)展開多次理性的剖析,層層深入,最終找出問題所在,為后續(xù)進(jìn)一步提升學(xué)生對沉淀轉(zhuǎn)化實(shí)質(zhì)的認(rèn)識打下了堅實(shí)的基礎(chǔ)。
2.基于模型揭示變化過程,打通概念原理知識間的聯(lián)系
化學(xué)中的模型認(rèn)知可理解為“利用模型進(jìn)行思維的一種方法”,即基于一定的感性認(rèn)識,以理想化的思維方式對看不見的化學(xué)原型客體進(jìn)行近似、簡化的摹寫,以揭示其本質(zhì)和規(guī)律的一種科學(xué)抽象方法。電化學(xué)原理及其裝置是高中階段學(xué)生認(rèn)識的典型學(xué)科模型,學(xué)生認(rèn)識其功能主要有:化學(xué)能與電能間的能量轉(zhuǎn)換、應(yīng)用原電池或電解池原理制備物質(zhì)等。本課時基于原電池裝置開展實(shí)驗(yàn)研究,將試管實(shí)驗(yàn)中不易觀察到的沉淀轉(zhuǎn)化現(xiàn)象轉(zhuǎn)化為具有說服力的可觀測的電壓數(shù)據(jù),用電壓數(shù)據(jù)產(chǎn)生的變化揭示化學(xué)反應(yīng)過程,為拓展學(xué)生的實(shí)驗(yàn)設(shè)計思路提供了新的角度和路徑,并據(jù)此轉(zhuǎn)化為今后研究同類型問題的一般思路與方法。在探究活動中,學(xué)生積極、主動參與實(shí)驗(yàn)過程,充分體驗(yàn)和感悟概念原理知識對實(shí)踐的指導(dǎo)價值,承前啟后,在學(xué)習(xí)過程中收獲成就感。
六、結(jié)束語
總之,證據(jù)推理與模型認(rèn)知不僅是化學(xué)科學(xué)發(fā)展的重要元素,也是化學(xué)學(xué)習(xí)中不可或缺的認(rèn)知能力。這些能力不僅有助于學(xué)生深刻理解知識是如何建構(gòu)的,更有利于學(xué)生的知識遷移。2017版新課標(biāo)提出以素養(yǎng)發(fā)展導(dǎo)向的教學(xué),發(fā)展學(xué)生的學(xué)科核心素養(yǎng),需要廣大一線教師在每一節(jié)常態(tài)課上扎扎實(shí)實(shí)地去設(shè)計教學(xué),改變以往的教學(xué)范式,大跨步地開展學(xué)科素養(yǎng)導(dǎo)向下的教學(xué)實(shí)踐,進(jìn)行更多有益地探索與嘗試。

